Vaccine Covid-19 Việt Nam phê duyệt khẩn cấp đều qua 3 lần thử nghiệm lâm sàng
23/06/2021 15:23 GMT+7 | Trong nước
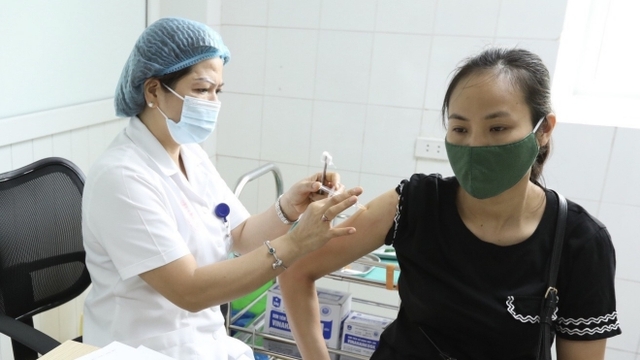
(Thethaovanhoa.vn) - Theo thông tin từ Bộ Y tế, tính đến ngày 23/6, Việt Nam đã phê duyệt có điều kiện cho 4 loại vaccine phòng COVID-19 bao gồm: Comirnaty của Pfizer, A2D1222 của AstraZeneca, Sputnik-V của Gamalaya, Vero-Cell của Sinopharm để phục vụ nhu cầu cấp bách phòng, chống dịch. Ngoài ra, vaccine Moderna cũng đang trong quá trình được xem xét phê duyệt.
Cũng như thông lệ quốc tế, tất cả các loại vaccine phòng COVID-19 trước khi đưa vào sử dụng khẩn cấp tại Việt Nam đều phải đảm bảo 3 yếu tố: an toàn, sinh miễn dịch và quan trọng nhất là hiệu quả bảo vệ.
Tất cả các vaccine nói trên đều phải trải qua 3 giai đoạn thử nghiệm lâm sàng, trong đó thử nghiệm lâm sàng giai đoạn 3 có quy mô từ 20.000 đến 50.000 người tham gia. Cụ thể: Vaccine của AstraZeneca được thử nghiệm lâm sàng giai đoạn 3 tại 11 quốc gia với 49.626 người tham gia. Vaccine Vero-Cell của Sinopharm được thử nghiệm lâm sàng tại 6 quốc gia với trên 45.000 người tham gia.
Vaccine Sputnik-V được thử nghiệm lâm sàng tại 5 quốc gia với 21.977 người tham gia. Vaccine của Pfizer được thử nghiệm lâm sàng tại 6 quốc gia với 43.418 người tham gia. Vaccine của Moderna được thử nghiệm tại 4 quốc gia với 30.420 người tham gia.
Trong bối cảnh dịch COVID-19 bùng phát rộng trên toàn thế giới, việc cấp phép khẩn cấp cho một loại vaccine phòng COVID-19 là điều cần thiết. Tuy nhiên, điều này không có nghĩa là bỏ qua các giai đoạn thử nghiệm lâm sàng bắt buộc.
Việc cấp phép khẩn cấp sử dụng vaccine phòng COVID-19 hiện nay là do điều kiện dịch bệnh nên chưa đủ thời gian để theo dõi vaccine trong thời gian dài như thông lệ. Mặc dù vậy, để đảm bảo tính an toàn, vaccine vẫn phải được thực hiện đầy đủ quy trình đánh giá hiệu quả bảo vệ.
- Bộ Y tế khẳng định chỉ cấp phép khi vaccine có đầy đủ dữ liệu khoa học
- Hoàn tất 1.000 mũi đầu tiên thử nghiệm giai đoạn 3 vaccine phòng Covid-19 Nano Covax
- Thành phố Hồ Chí Minh: Tiêm vaccine phòng Covid-19 đầu tiên cho 5.000 công nhân tại Khu chế xuất Tân Thuận
Theo quy định của Tổ chức Y tế Thế giới (WHO) và các nước như Mỹ, các quốc gia thuộc Liên minh châu Âu, Nhật Bản, Hàn Quốc…, vaccine trước khi đưa vào sử dụng khẩn cấp bắt buộc phải được thử nghiệm lâm sàng trên người với 3 giai đoạn, trong đó giai đoạn 3 là quan trọng nhất.
Giai đoạn này được thực hiện trên quy mô lớn với mục tiêu đánh giá tính an toàn và hiệu quả bảo vệ của vaccine. Kết quả của giai đoạn 3 sẽ quyết định việc vaccine đó có được phê duyệt để triển khai tiêm chủng rộng rãi hay không. Kể cả sau khi đã được phê duyệt, các loại vaccine đó đều phải liên tục bổ sung, cập nhật các thông tin, dữ liệu liên quan đến tính an toàn, hiệu quả trong quá trình sử dụng.
Thử nghiệm lâm sàng giai đoạn 1 và 2 được tiến hành ở quy mô nhỏ trên một số nhóm quần thể để kiểm tra độ an toàn, tính sinh miễn dịch và xác định liều lượng tối ưu. Việc đánh giá tính sinh miễn dịch trong giai đoạn 1 và 2 này không phải là yếu tố quyết định cho việc phê duyệt khẩn cấp. Chỉ có kết quả thử nghiệm lâm sàng giai đoạn 3 mới là yếu tố quyết định để đánh giá vaccine này có hiệu quả bảo vệ hay không, có làm giảm nguy cơ mắc COVID-19 hay không hoặc giảm nhẹ tình trạng bệnh hay không.
TTXVN
-

-

-

-

-

-
 23/04/2024 21:22 0
23/04/2024 21:22 0 -

-

-

-
 23/04/2024 20:42 0
23/04/2024 20:42 0 -

-

-

-
-
-
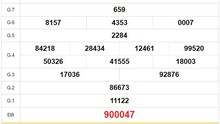
-
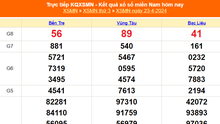
-
 23/04/2024 20:15 0
23/04/2024 20:15 0 -
 23/04/2024 20:13 0
23/04/2024 20:13 0 -
 23/04/2024 19:59 0
23/04/2024 19:59 0 - Xem thêm ›